2021年5月12日,我校科研人员在《Frontiers in Cell and Developmental Biolgoy》杂志在线发表题为“Alterations of Golgi Structural Proteins and Glycosylation Defects in Cancer”的综述文章,系统总结了高尔基体结构以及结构蛋白异常介导肿瘤细胞中糖基化修饰紊乱的作用机制。生物医学与健康学院、生命科学技术学院张晓妍教授为该综述论文的通讯作者。
在真核生物中,蛋白质糖基化是一种极为普遍的翻译后修饰方式,对蛋白质的正确折叠、稳定、功能发挥以及多种细胞活动起重要调节作用。肿瘤细胞的一个重要特征是细胞膜蛋白和分泌蛋白的糖基化修饰紊乱。而不同于核酸复制和蛋白质翻译,糖链合成没有模板,呈现复杂性和多样性,使其鉴定和分析至今仍为科学研究的难点。在糖基化过程中,不仅需要糖基转移酶、糖苷酶、核苷酸糖转运蛋白和底物的准确定位和协同作用,还需要一个高效的加工场所,负责糖链加工的准确性,而哺乳动物细胞中高尔基体独特的膜状堆叠结构正是为此演化而来。因此推测,高尔基体结构以及结构蛋白异常与肿瘤细胞糖基化修饰紊乱密切相关。
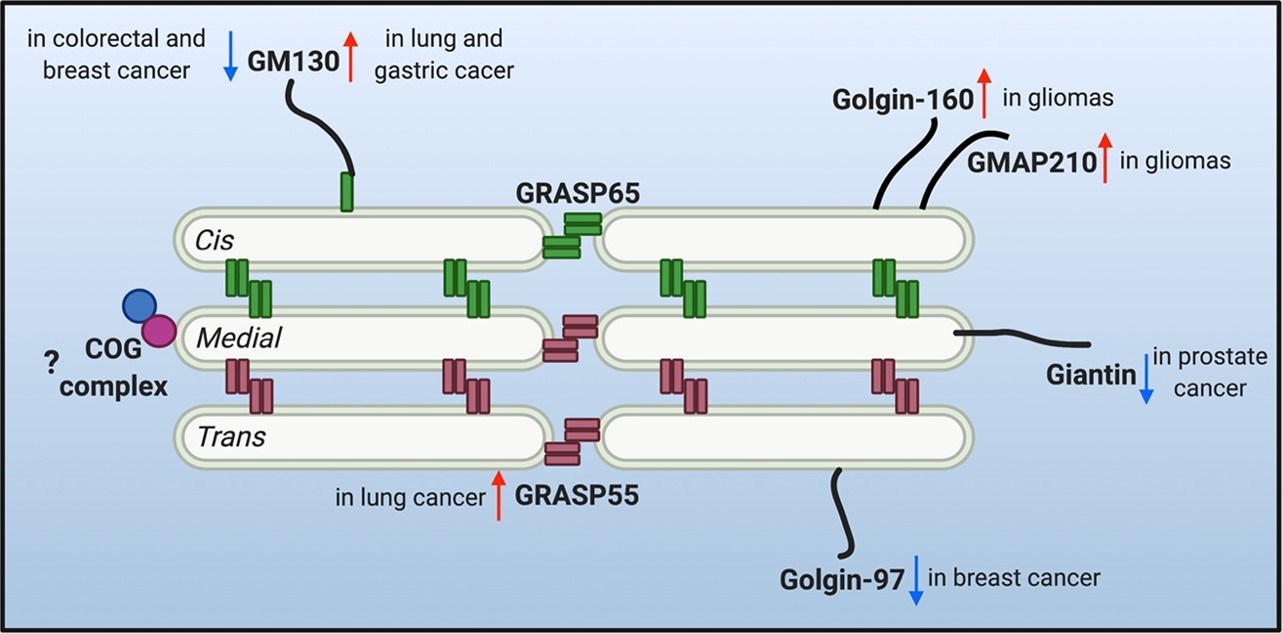
图1. 不同肿瘤细胞中高尔基体结构蛋白表达量的变化,
蓝色箭头表示表达量下降,红色箭头表示表达量升高。
已有报道,GRASPs (包括GRASP55和GRASP65) 和Golgin蛋白家族构成高尔基体基质,主要维护哺乳动物细胞中高尔基体的膜状堆叠和带状结构,负责正常的蛋白质运输和精准糖基化修饰。该综述系统总结了已经报道的高尔基体结构蛋白的表达量在肿瘤细胞中的表现,显示并无明显规律,不同肿瘤类型中高尔基体结构蛋白表达会有区别(图1 )。深入的机制研究发现, GM130、Giantin和GOLPH3参与糖基化酶在高尔基体中的正确定位进而影响蛋白质的顺序糖基化修饰,而其他结构蛋白直接或间接作用于膜蛋白的糖基化修饰机制还有待研究。综述还总结了肿瘤细胞中高尔基体的结构变化,表明高尔基体碎片化或者紧致化都可能在肿瘤细胞中发现,而这可能与肿瘤发生发展的不同阶段相关。综述提出“高尔基体变化是否促进肿瘤发生”这个重要的科学问题仍需要深入探索,而肿瘤细胞中糖基化修饰紊乱的研究需要细胞信号转导、蛋白质运输、糖生物学以及高分辨率显微镜等的交叉融合。

